La FDA approva il TAVR per i pazienti a basso rischio crea un cambiamento di paradigma in cardiologia JEFF ZAGOUDIS, ASSOCIATE EDITOR, E DAVE FORNELL, EDITOR
FDA approva le valvole Sapav 3, CoreValve Evolut TAVR per pazienti a basso rischio, TAVR ora disponibile per tutti i pazienti con stenosi aortica sintomatica grave
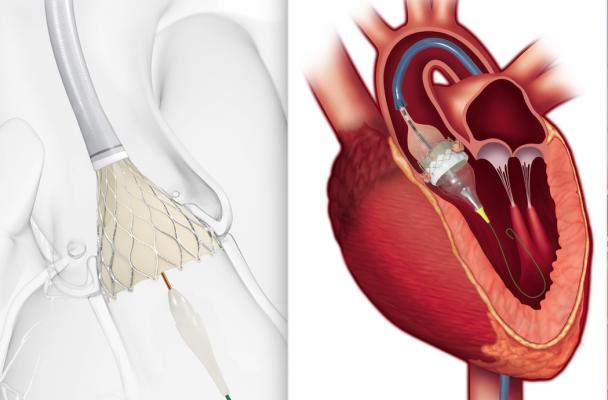
A sinistra, un esempio dell'inizio della distribuzione di una valvola di sostituzione aortica transcatetere auto-espandibile CoreValve Evolut (TAVR). A destra, un'illustrazione dell'espansione del palloncino finale di una valvola TAVR Edien Lifesciences Sapien 3. Entrambe le valvole hanno ricevuto l'autorizzazione FDA simultanea per l'uso in pazienti chirurgici a basso rischio. L'eliminazione di quest'ultimo ostacolo ora consente un uso diffuso del TAVR minimamente invasivo in tutti i pazienti che altrimenti avrebbero bisogno di una sostituzione della valvola chirurgica a cuore aperto.
16 agosto 2019 - Con una mossa coordinata, la Food and Drug Administration (FDA) americana ha aperto oggi l'uso della sostituzione transcatetere della valvola aortica (TAVR) a pazienti a basso rischio. La FDA ha contemporaneamente ampliato le indicazioni per l'uso sia della valvola Sapien 3 di Edwards Lifesciences sia del sistema CoreValve Evolut di Medtronic per questa popolazione di pazienti. La popolazione di pazienti a basso rischio è l'ultima categoria di rischio chirurgico da approvare per la TAVR, un'alternativa minimamente invasiva alla sostituzione della valvola chirurgica a cuore aperto (SAVR) e comprende pazienti che possono essere più giovani e più attivi rispetto ai pazienti ad alto rischio. Entrambi i dispositivi sono indicati per pazienti con stenosi aortica grave, sintomatica (AS) .
L'indicazione ampliata della FDA è stata ampiamente anticipata a causa degli eccellenti risultati della sperimentazione clinica. I dati della sperimentazione clinica fino ad oggi sia per CoreValve che per Sapien 3 sono stati eccezionali, altrettanto performanti o migliori, rispetto alla SAVR in pazienti ad alto rischio, a rischio intermedio ea basso rischio. L'uso approvato nei pazienti a basso rischio apre la strada a un'espansione ancora più rapida, poiché gli esperti si aspettano ampiamente che la procedura basata sul transcatetere inizi a sostituire una grande fascia di volume di sostituzione della valvola chirurgica nei prossimi due anni.
Approvazione Sapien 3 basata sulla prova PARTNER 3
 L'approvazione a basso rischio di Sapien 3 TAVR si basava sui dati del punto di riferimento PARTNER 3 Trial, uno studio clinico randomizzato valutato in modo indipendente che confrontava gli esiti tra TAVR e chirurgia a cuore aperto. TAVR con il sistema Sapien 3 ha raggiunto la superiorità, con una riduzione del 46 percento del tasso di eventi per l'endpoint primario dello studio, che era un composto di mortalità per tutte le cause, ictus e reospedalizzazione in un anno. I dati sono stati presentati a marzo alla 68a sessione scientifica annuale dell'American College of Cardiology (ACC) e pubblicati contemporaneamente sul New England Journal of Medicine .
L'approvazione a basso rischio di Sapien 3 TAVR si basava sui dati del punto di riferimento PARTNER 3 Trial, uno studio clinico randomizzato valutato in modo indipendente che confrontava gli esiti tra TAVR e chirurgia a cuore aperto. TAVR con il sistema Sapien 3 ha raggiunto la superiorità, con una riduzione del 46 percento del tasso di eventi per l'endpoint primario dello studio, che era un composto di mortalità per tutte le cause, ictus e reospedalizzazione in un anno. I dati sono stati presentati a marzo alla 68a sessione scientifica annuale dell'American College of Cardiology (ACC) e pubblicati contemporaneamente sul New England Journal of Medicine .
"La prova PARTNER 3 ha dimostrato che i pazienti a basso rischio trattati con Sapien 3 TAVR hanno avuto esiti straordinari con tassi di mortalità dell'1,0% o ictus invalidante a un anno, un breve periodo di degenza e il 96% dimessi a casa o in cura di sé. Sapien 3 è l'unica valvola per raggiungere la superiorità rispetto alla chirurgia basata sull'endpoint primario prespecificato ", ha affermato Martin B. Leon, MD, direttore del Center for Interventional Vascular Therapy presso il New York-Presbyterian / Columbia University Medical Center e professore di medicina presso il Columbia University College of Physicians and Surgeons. "L'approvazione della FDA di oggi di Sapien 3 TAVR amplierà l'accesso a questa terapia comprovata, che dovrebbe essere considerata il trattamento preferito per la maggior parte dei pazienti con AS grave a basso rischio." Leon è il co-principale investigatore nazionale della versione di prova PARTNER 3.
Questa approvazione a basso rischio copre le valvole Sapien 3 e Sapien 3 Ultra in tutte le dimensioni.
Approvazione CoreValve basata sulla prova a basso rischio Evolut
 L'approvazione ampliata delle indicazioni per i sistemi Medtronic CoreValve Evolut R e CoreValve Evolut Pro TAVR si basa su dati clinici randomizzatidalla prova Evolut a basso rischio globale, prospettica e multicentrica, che ha valutato tre generazioni di valvole (valvole CoreValve, Evolut R ed Evolut Pro) in oltre 1.400 pazienti. I dati hanno mostrato che TAVR ha un eccellente profilo di sicurezza ed è un'opzione terapeutica efficace nei pazienti a basso rischio, con degenze ospedaliere più brevi e punteggi di qualità della vita migliorati rispetto a SAVR. Oltre a un tasso significativamente più basso del composito di morte per qualsiasi causa o ictus invalidante con TAVR a 30 giorni, il sistema Evolut TAVR ha dimostrato prestazioni emodinamiche superiori con gradienti della valvola aortica media significativamente più bassi e aree di orifizio più grandi (EOA) rispetto alla chirurgia - fattori importanti per i pazienti più attivi. Tuttavia, la percentuale di nuovi impianti di pacemaker e rigurgito aortico residuo era più elevata nel gruppo TAVR rispetto a SAVR.
L'approvazione ampliata delle indicazioni per i sistemi Medtronic CoreValve Evolut R e CoreValve Evolut Pro TAVR si basa su dati clinici randomizzatidalla prova Evolut a basso rischio globale, prospettica e multicentrica, che ha valutato tre generazioni di valvole (valvole CoreValve, Evolut R ed Evolut Pro) in oltre 1.400 pazienti. I dati hanno mostrato che TAVR ha un eccellente profilo di sicurezza ed è un'opzione terapeutica efficace nei pazienti a basso rischio, con degenze ospedaliere più brevi e punteggi di qualità della vita migliorati rispetto a SAVR. Oltre a un tasso significativamente più basso del composito di morte per qualsiasi causa o ictus invalidante con TAVR a 30 giorni, il sistema Evolut TAVR ha dimostrato prestazioni emodinamiche superiori con gradienti della valvola aortica media significativamente più bassi e aree di orifizio più grandi (EOA) rispetto alla chirurgia - fattori importanti per i pazienti più attivi. Tuttavia, la percentuale di nuovi impianti di pacemaker e rigurgito aortico residuo era più elevata nel gruppo TAVR rispetto a SAVR.
“La maggior parte dei miei pazienti desidera una valvola sostitutiva che riduca al minimo il rischio di morte, ictus e altri eventi cardiovascolari durante la procedura e consenta loro di lasciare l'ospedale più velocemente e di riprendersi prima. Nei pazienti appropriati per una valvola biologica, tale opzione sarà TAVR ", ha affermato Michael Reardon, MD , chirurgo cardiotoracico presso il metodista Houston DeBakey Heart & Vascular Center, ricercatore principale e autore senior della sperimentazione a basso rischio Evolut. "Con l'approvazione a basso rischio, la stratificazione del rischio per il trattamento TAVR sta diventando obsoleta e le squadre del cuore dovranno probabilmente valutare le opzioni di trattamento in base alle caratteristiche anatomiche, ai fattori di rischio concomitanti e anche alle preferenze del paziente."
Il sistema Evolut TAVR consente una migliore funzionalità cardiaca che aiuta molti pazienti a riprendere i livelli di attività di stenosi pre-aortica. La valvola è progettata con un telaio in nitinol autoespandibile che conforma la valvola di sostituzione all'anello nativo con una forza radiale costante e include un involucro di tessuto esterno che aumenta il contatto della superficie con l'anatomia nativa per una migliore tenuta della valvola. La piattaforma CoreValve Evolut TAVR riporta i dati sulla durabilità fino a otto anni con il Registro italiano.
"I pazienti a basso rischio erano più giovani e più sani di quelli arruolati nei nostri studi precedenti e erano in grado di valutare meglio i rischi e i benefici dell'intervento chirurgico o della TAVR in base alle loro preferenze di valore", ha affermato Jeffrey J. Popma, MD , direttore dell'intervento cardiologia presso il Beth Israel Deaconess Medical Center di Boston e co-principale investigatore nella sperimentazione a basso rischio Evolut. "La nostra impressione è che i pazienti saranno ora in grado di fare una scelta sul metodo di sostituzione della valvola aortica sulla base di una discussione informata rischio-beneficio con il loro team cardiaco"
Chi dovrebbe sottoporsi a un intervento chirurgico rispetto a TAVR?
La valutazione di Reardon secondo cui la stratificazione del rischio per TAVR sta diventando obsoleta è un sentimento che ha fatto eco a molte conferenze di cardiologia negli ultimi due anni. Sia i cardiochirurghi che i cardiologi interventisti hanno affermato che la domanda è passata da chi dovrebbe qualificarsi per TAVR a chi dovrebbe qualificarsi per un intervento chirurgico. Il consenso generale è che circa il 25 percento dei pazienti sarà più adatto all'intervento chirurgico per vari motivi, ma il 75 percento delle sostituzioni della valvola aortica passerà al TAVR nei prossimi anni.
La stima è che il 76 percento delle sostituzioni della valvola aortica sarà effettuato dal TAVR entro il 2025, ha spiegato Ron Waksman, MD , direttore associato della divisione di cardiologia e direttore della ricerca cardiovascolare e dell'istruzione avanzata, Medstar Heart Institute, in una recente sessione TAVR presso l' incontro della Society of Cardiolvascular Computed Tomography (SCCT) 2019. Ha detto che le curve dei dati della sperimentazione clinica mostrano che SAVR e TAVR sono fondamentalmente uno sopra l'altro.
"I nostri risultati a Medstar sono stati altrettanto buoni dei chirurghi nella sperimentazione del PARTNER 3. Quale terapia pensi sia migliore - penso che i dati siano chiari"
Facilitare l'onere della stenosi aortica
La grave stenosi aortica colpisce circa 165.000 pazienti a basso rischio all'anno negli Stati Uniti, in Europa occidentale e in Giappone, che si verificano quando la valvola aortica diventa malata (stenotica). I lembi valvolari diventano rigidi e ispessiti e hanno difficoltà ad aprirsi e chiudersi, rendendo più duro il lavoro del cuore per pompare il sangue al resto del corpo e, quindi, influenzando le attività quotidiane di un individuo. Se non trattati, i pazienti con grave stenosi aortica possono morire per insufficienza cardiaca in meno di due anni.
"Questa nuova approvazione espande significativamente il numero di pazienti che possono essere trattati con questa procedura meno invasiva per la sostituzione della valvola aortica e segue una revisione approfondita dei dati che dimostrano che questi dispositivi sono sicuri ed efficaci per questa popolazione più ampia", ha affermato Bram Zuckerman, MD , direttore dell'Ufficio dei dispositivi cardiovascolari nel Centro per i dispositivi e la salute radiologica della FDA. "Mentre la FDA valuta nuove tecnologie mediche o usi estesi per prodotti precedentemente approvati come questi, l'agenzia rimane impegnata a valutare prove da studi clinici e dati clinici del mondo reale sia in ambito pre-mercato che post-mercato per garantire che i pazienti abbiano accesso a dispositivi medici di qualità, sicuri ed efficaci. "
Come la chirurgia di sostituzione della valvola a cuore aperto, il trattamento con valvole cardiache transcatetere è associato a un potenziale rischio di gravi complicanze. Le gravi complicanze associate all'uso di questi dispositivi includono morte, ictus, danno renale acuto, infarto, sanguinamento e necessità di un pacemaker permanente.
La FDA ha affermato che le valvole cardiache transcatetere non devono essere utilizzate in pazienti che non possono tollerare farmaci per fluidificare il sangue o avere un'infezione attiva nel cuore o altrove. Inoltre, i dispositivi CoreValve Evolut R e CoreValve Evolut Pro non devono essere utilizzati in pazienti con sensibilità al titanio o al nichel. Inoltre, non è stata stabilita la durabilità a lungo termine delle valvole cardiache transcatetere rispetto alle valvole impiantate chirurgicamente. I pazienti, in particolare i più piccoli, dovrebbero discutere le opzioni di trattamento disponibili con il loro team di cura del cuore per selezionare la terapia che meglio soddisfa le loro aspettative e stile di vita.
Questi dispositivi sono stati approvati utilizzando il percorso di approvazione del mercato (PMA). L'approvazione pre-vendita è il tipo più rigoroso di applicazione di marketing per dispositivi richiesta dalla FDA e si basa sulla determinazione da parte della FDA che l'applicazione PMA contenga prove scientifiche valide e sufficienti per fornire ragionevoli garanzie che il dispositivo è sicuro ed efficace per gli usi previsti ).
Come parte dell'approvazione di questi dispositivi, la FDA richiede a ciascun produttore di continuare a seguire i pazienti arruolati nei loro studi randomizzati per 10 anni per monitorare ulteriormente la sicurezza e l'efficacia della valvola aortica transcatetere, inclusa la durata della valvola a lungo termine. I produttori parteciperanno inoltre al Registro delle terapie transcatetere per la terapia della valvola transcatetere della Society of Thoracic Surgeons / American College of Cardiology (Registro STS / ACC TVT) per fornire alla FDA una sorveglianza aggiuntiva di questi dispositivi per un periodo di 10 anni.
fonte link at https://www.dicardiology.com/article/fda-approves-tavr-low-risk-patients-creates-paradigm-shift-cardiology